Mecanismos moleculares que controlan el ritmo circadiano
![]()
2017-10-02
La Asamblea Nobel del Karolinska Institutet ha decidido hoy otorgar
el Premio Nobel de Fisiología o Medicina 2017
conjuntamente con
Jeffrey C. Hall, Michael Rosbash y Michael W. Young
por sus descubrimientos de los mecanismos moleculares que controlan el ritmo circadiano
La vida en la Tierra está adaptada a la rotación de nuestro planeta. Desde hace muchos años sabemos que los organismos vivos, incluidos los humanos, tienen un reloj biológico interno que les ayuda a anticipar y adaptarse al ritmo regular del día. Pero, ¿cómo funciona realmente este reloj? Jeffrey C. Hall, Michael Rosbash y Michael W. Young pudieron mirar dentro de nuestro reloj biológico y dilucidar su funcionamiento interno. Sus descubrimientos explican cómo las plantas, los animales y los seres humanos adaptan su ritmo biológico para que esté sincronizado con las revoluciones de la Tierra.
Utilizando moscas de la fruta como organismo modelo, los premios Nobel de este año aislaron un gen que controla el ritmo biológico diario normal. Demostraron que este gen codifica una proteína que se acumula en la célula durante la noche y luego se degrada durante el día. Posteriormente, identificaron componentes proteicos adicionales de esta maquinaria, exponiendo el mecanismo que gobierna el mecanismo de relojería autosuficiente dentro de la célula. Ahora reconocemos que los relojes biológicos funcionan con los mismos principios en las células de otros organismos multicelulares, incluidos los humanos.
Con exquisita precisión, nuestro reloj interno adapta nuestra fisiología a las dramáticamente diferentes fases del día. El reloj regula funciones críticas como el comportamiento, los niveles hormonales, el sueño, la temperatura corporal y el metabolismo. Nuestro bienestar se ve afectado cuando hay un desajuste temporal entre nuestro entorno externo y este reloj biológico interno, por ejemplo, cuando viajamos a través de varias zonas horarias y experimentamos "jet lag". También hay indicios de que la desalineación crónica entre nuestro estilo de vida y el ritmo dictado por nuestro cronometrador interior se asocia con un mayor riesgo de diversas enfermedades.
Nuestro reloj interior
La mayoría de los organismos vivos se anticipan y se adaptan a los cambios diarios del medio ambiente. Durante el siglo XVIII, el astrónomo Jean Jacques d'Ortous de Mairan estudió las plantas de mimosa y descubrió que las hojas se abrían hacia el sol durante el día y se cerraban al anochecer. Se preguntó qué pasaría si la planta se colocara en constante oscuridad. Descubrió que, independientemente de la luz solar diaria, las hojas continuaban siguiendo su oscilación diaria normal ( Figura 1 ). Las plantas parecían tener su propio reloj biológico.
Otros investigadores encontraron que no solo las plantas, sino también los animales y los humanos, tienen un reloj biológico que ayuda a preparar nuestra fisiología para las fluctuaciones del día. Esta adaptación regular se conoce como el ritmo circadiano , originado de las palabras latinas circa que significa "alrededor" y dies que significa "día". Pero el funcionamiento de nuestro reloj biológico circadiano interno sigue siendo un misterio.
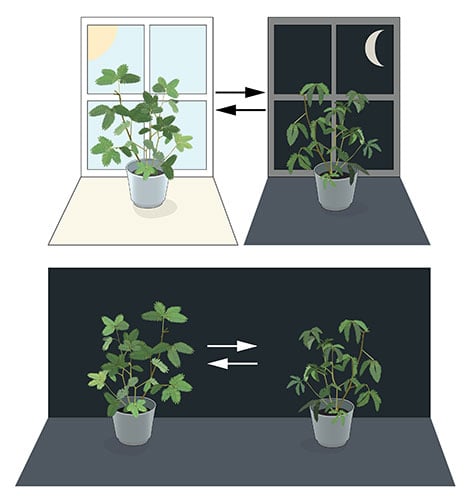
Figura 1. Un reloj biológico interno. Las hojas de la mimosa se abren hacia el sol durante el día pero se cierran al anochecer (parte superior). Jean Jacques d'Ortous de Mairan colocó la planta en constante oscuridad (parte inferior) y encontró que las hojas continúan siguiendo su ritmo diario normal, incluso sin fluctuaciones en la luz diaria.
Identificación de un gen reloj
Durante la década de 1970, Seymour Benzer y su alumno Ronald Konopka preguntaron si sería posible identificar genes que controlan el ritmo circadiano en las moscas de la fruta. Demostraron que las mutaciones en un gen desconocido alteraron el reloj circadiano de las moscas. Llamaron a este período genético . Pero, ¿cómo podría influir este gen en el ritmo circadiano?
Los premios Nobel de este año, que también estaban estudiando las moscas de la fruta, tenían como objetivo descubrir cómo funciona realmente el reloj. En 1984, Jeffrey Hall y Michael Rosbash, trabajando en estrecha colaboración en la Universidad Brandeis en Boston, y Michael Young en la Universidad Rockefeller en Nueva York, lograron aislar el gen del período . Jeffrey Hall y Michael Rosbash luego descubrieron que PER, la proteína codificada por período, se acumulaba durante la noche y se degradaba durante el día. Así, los niveles de proteína PER oscilan durante un ciclo de 24 horas, en sincronía con el ritmo circadiano.
Un mecanismo de relojería autorregulado
El siguiente objetivo clave era comprender cómo se podían generar y mantener esas oscilaciones circadianas. Jeffrey Hall y Michael Rosbash plantearon la hipótesis de que la proteína PER bloqueaba la actividad del gen del período . Razonaron que mediante un circuito de retroalimentación inhibitoria, la proteína PER podría prevenir su propia síntesis y, por lo tanto, regular su propio nivel en un ritmo cíclico continuo ( Figura 2A ).
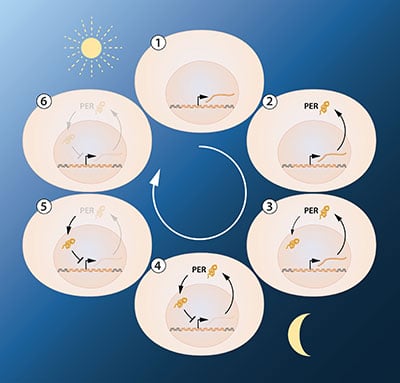
Figura 2A. Una ilustración simplificada de la regulación por retroalimentación del gen del período . La figura muestra la secuencia de eventos durante una oscilación de 24 horas. Cuando el gen del período está activo, se produce el ARNm del período . El ARNm se transporta al citoplasma de la célula y sirve como molde para la producción de la proteína PER . La proteína PER se acumula en el núcleo de la célula, donde se bloquea la actividad del gen del período . Esto da lugar al mecanismo de retroalimentación inhibitoria que subyace al ritmo circadiano.
El modelo era tentador, pero faltaban algunas piezas del rompecabezas. Para bloquear la actividad del gen period , la proteína PER, que se produce en el citoplasma, tendría que llegar al núcleo celular, donde se encuentra el material genético. Jeffrey Hall y Michael Rosbash habían demostrado que la proteína PER se acumula en el núcleo durante la noche, pero ¿cómo llegó allí? En 1994, Michael Young descubrió un segundo gen de reloj, atemporal , que codifica la proteína TIM necesaria para un ritmo circadiano normal. En un trabajo elegante, demostró que cuando TIM se unió a PER, las dos proteínas pudieron ingresar al núcleo celular donde bloquearon la actividad del gen del período para cerrar el ciclo de retroalimentación inhibitoria ( Figura 2B ).
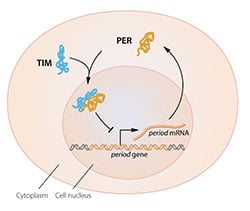
Figura 2B. Una ilustración simplificada de los componentes moleculares del reloj circadiano.
Tal mecanismo de retroalimentación regulatoria explica cómo surgió esta oscilación de los niveles de proteína celular, pero las preguntas persisten. ¿Qué controló la frecuencia de las oscilaciones? Michael Young identificó otro gen, doubletime , que codifica la proteína DBT que retrasó la acumulación de la proteína PER. Esto proporcionó información sobre cómo se ajusta una oscilación para coincidir más estrechamente con un ciclo de 24 horas.
Los descubrimientos que cambiaron el paradigma de los galardonados establecieron principios mecanicistas clave para el reloj biológico. Durante los años siguientes se aclararon otros componentes moleculares del mecanismo de relojería, explicando su estabilidad y función. Por ejemplo, los galardonados de este año identificaron proteínas adicionales necesarias para la activación del gen del período , así como para el mecanismo por el cual la luz puede sincronizar el reloj.
Mantener el tiempo en nuestra fisiología humana
El reloj biológico está involucrado en muchos aspectos de nuestra compleja fisiología. Ahora sabemos que todos los organismos multicelulares, incluidos los humanos, utilizan un mecanismo similar para controlar los ritmos circadianos. Una gran proporción de nuestros genes están regulados por el reloj biológico y, en consecuencia, un ritmo circadiano cuidadosamente calibrado adapta nuestra fisiología a las diferentes fases del día ( Figura 3 ). Desde los descubrimientos fundamentales de los tres galardonados, la biología circadiana se ha convertido en un campo de investigación vasto y altamente dinámico, con implicaciones para nuestra salud y bienestar.
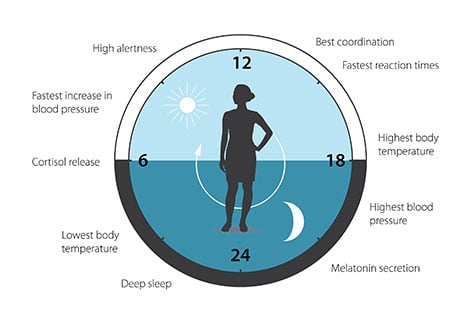
Figura 3. El reloj circadiano se anticipa y adapta nuestra fisiología a las diferentes fases del día. Nuestro reloj biológico ayuda a regular los patrones de sueño, la conducta alimentaria, la liberación de hormonas, la presión arterial y la temperatura corporal.
Key publications
Zehring, W.A., Wheeler, D.A., Reddy, P., Konopka, R.J., Kyriacou, C.P., Rosbash, M., and Hall, J.C. (1984). P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell 39, 369–376.
Bargiello, T.A., Jackson, F.R., and Young, M.W. (1984). Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature 312, 752–754.
Siwicki, K.K., Eastman, C., Petersen, G., Rosbash, M., and Hall, J.C. (1988). Antibodies to the period gene product of Drosophila reveal diverse tissue distribution and rhythmic changes in the visual system. Neuron 1, 141–150.
Hardin, P.E., Hall, J.C., and Rosbash, M. (1990). Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels. Nature 343, 536–540.
Liu, X., Zwiebel, L.J., Hinton, D., Benzer, S., Hall, J.C., and Rosbash, M. (1992). The period gene encodes a predominantly nuclear protein in adult Drosophila. J Neurosci 12, 2735–2744.
Vosshall, L.B., Price, J.L., Sehgal, A., Saez, L., and Young, M.W. (1994). Block in nuclear localization of period protein by a second clock mutation, timeless. Science 263, 1606–1609.
Price, J.L., Blau, J., Rothenfluh, A., Abodeely, M., Kloss, B., and Young, M.W. (1998). double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation. Cell 94, 83–95.
Jeffrey C. Hall was born 1945 in New York, USA. He received his doctoral degree in 1971 at the University of Washington in Seattle and was a postdoctoral fellow at the California Institute of Technology in Pasadena from 1971 to 1973. He joined the faculty at Brandeis University in Waltham in 1974. In 2002, he became associated with University of Maine.
Michael Rosbash was born in 1944 in Kansas City, USA. He received his doctoral degree in 1970 at the Massachusetts Institute of Technology in Cambridge. During the following three years, he was a postdoctoral fellow at the University of Edinburgh in Scotland. Since 1974, he has been on faculty at Brandeis University in Waltham, USA.
Michael W. Young was born in 1949 in Miami, USA. He received his doctoral degree at the University of Texas in Austin in 1975. Between 1975 and 1977, he was a postdoctoral fellow at Stanford University in Palo Alto. From 1978, he has been on faculty at the Rockefeller University in New York.
Illustrations: © The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
The Nobel Assembly, consisting of 50 professors at Karolinska Institutet, awards the Nobel Prize in Physiology or Medicine. Its Nobel Committee evaluates the nominations. Since 1901 the Nobel Prize has been awarded to scientists who have made the most important discoveries for the benefit of mankind.
Nobel Prize® is the registered trademark of the Nobel Foundation


Comentarios