Revelan un circuito neural sexualmente diferenciado para detectar estímulos sociales
POR DIANE A. KELLY , ADDISON BILLING , JOSEPH BERGAN
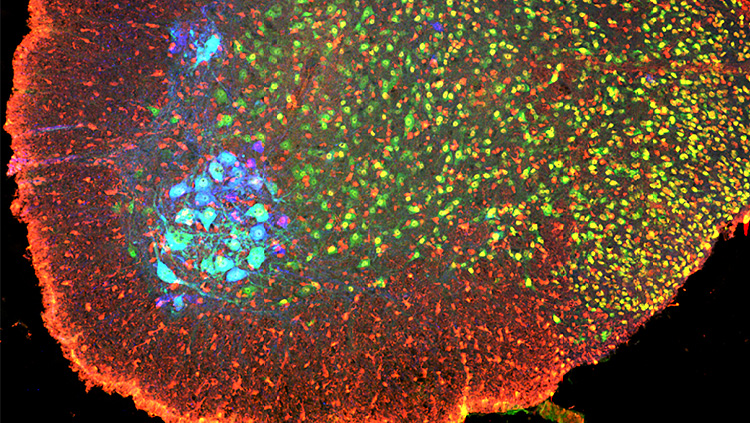
El material siguiente resume el artículo Synaptic Connections of Aromatase Circuits in the Medial Amygdala are Sex Specific, publicado el 29 de mayo de 2020 en eNeuro y escrito por Addison Billing, Marcelo Henrique Correia, Diane A. Kelly, Geng-Lin Li y Joseph Bergan .
Aspectos destacados:
- Las células productoras de aromatasa en la amígdala medial del ratón reciben información que se origina en las células sensoriales del órgano vomeronasal que expresan una única clase de receptores que se sabe que detectan sustancias químicas que transmiten información sobre la edad, el sexo y la condición de reproducción de otros ratones.
- No observamos diferencias de sexo en las propiedades electrofisiológicas intrínsecas de las células productoras de aromatasa en la amígdala medial; sin embargo, encontramos una fuerte diferencia de sexo anatómico en el número de sinapsis que conectan el bulbo olfatorio accesorio - y por lo tanto el órgano vomeronasal - a estas células.
- Los machos tienen casi un orden de magnitud más de estas conexiones sinápticas que las hembras, una diferencia anatómica que podría desempeñar un papel en la configuración de las diferencias sexuales en los comportamientos sociales mediados por la amígdala medial.
 |
Pregunta de estudio
¿Existen diferencias sexuales en la anatomía y / o función del circuito que puedan producir las diferencias sexuales observadas en los comportamientos sociales mediados por la amígdala medial?
Cómo esta investigación avanza lo que sabemos
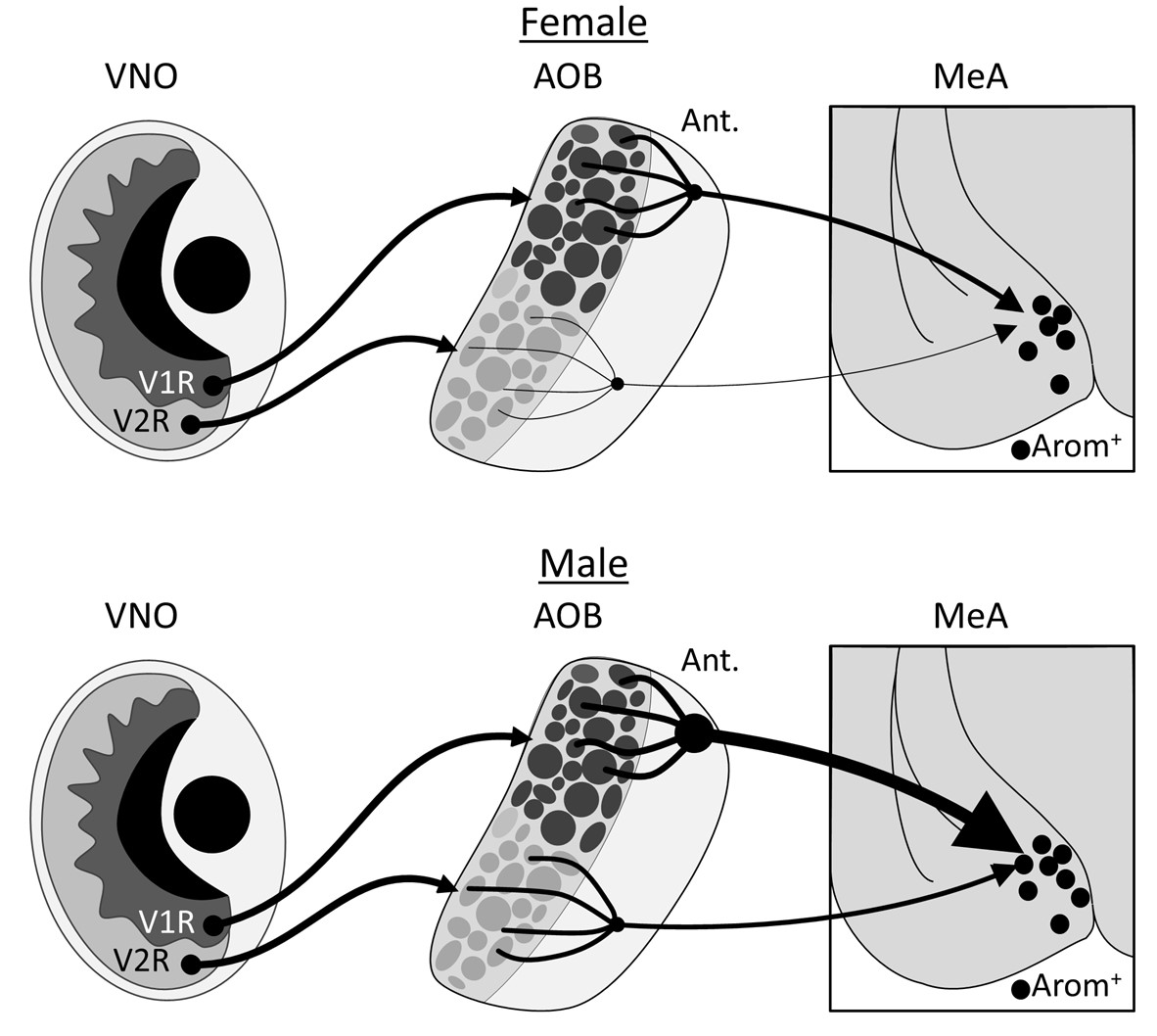
Los ratones transmiten su sexo, edad y disponibilidad reproductiva a otros ratones con marcadores químicos que detectan con células sensoriales dentro de una estructura llamada órgano vomeronasal (VNO) que está incrustado en el tabique nasal. Las señales de estas células se transmiten a la amígdala medial (MeA), una región del cerebro que es un centro para el procesamiento de la conducta social, en un circuito de dos neuronas que pasa a través del bulbo olfatorio accesorio (AOB). Se sabe que el MeA muestra diferencias de sexo cuando procesa información de olor sobre el sexo de otro ratón, lo que implica que existen diferencias de sexo en la anatomía y función de sus circuitos. Investigamos si estas diferencias podrían encontrarse en un subconjunto de neuronas MeA que producen aromatasa, una enzima clave para producir estradiol,
Diseño / Metodología Experimental
Utilizamos ratones modificados genéticamente para expresar proteína roja fluorescente en neuronas que producen aromatasa en el cerebro. Este rasgo nos permite distinguir estas células de otros tipos de neuronas dentro de la amígdala medial y examinar el comportamiento electrofisiológico de las neuronas que producen aromatasa frente a las que no lo hacen en la amígdala medial. También inyectamos un virus en la amígdala medial que llevaría una etiqueta verde fluorescente de las células positivas a la aromatasa infectadas a través de las sinapsis entrantes a las neuronas aguas arriba en sus circuitos. Luego hicimos transparentes estos cerebros y los fotografiamos con un microscopio de hoja de luz; estos datos nos permiten reconstruir las rutas y conexiones de todas las neuronas etiquetadas. En ambas partes del estudio, analizamos los datos con pruebas t no apareadas y un ANOVA de modelo mixto.
Resultados
Nuestras pruebas electrofisiológicas del MeA encontraron poca evidencia de diferencias de sexo en las células productoras de aromatasa para una serie de propiedades electrofisiológicas críticas que incluyen: resistencia de entrada, voltaje umbral para provocar un potencial de acción y el número de potenciales de acción producidos a niveles de corriente específicos. Tampoco encontramos diferencias de sexo para estas características en las neuronas aromatasa negativas. En cambio, encontramos que las células productoras de aromatasa en el MeA producían menos potenciales de acción en respuesta a los mismos niveles actuales que las neuronas aromatasa negativas, lo que sugiere que la aromatasa define una clase de neuronas MeA con propiedades electrofisiológicas compartidas.
Nuestras pruebas de rastreo de neuronas mostraron que las entradas a las neuronas MeA productoras de aromatasa desde el bulbo olfatorio anterior (AOB) se originan casi por completo en su región anterior; y sus árboles dendríticos se asociaron predominantemente con glomérulos que reciben información sensorial de las células V1R en el órgano vomeronasal. Los hombres tenían significativamente más de estas entradas que las mujeres, incluso después de que normalizamos el número de neuronas inicialmente infectadas en el MeA.
Interpretación
Las neuronas que expresan aromatasa en la amígdala medial se han implicado como partes clave de las vías que median los comportamientos sociales en ratones; Nuestros resultados muestran que estas células están en un circuito con células sensoriales que responden a sustancias químicas que transmiten señales sociales. El número de estas conexiones muestra una fuerte diferencia de sexo: en promedio, cada neurona que expresa aromatasa en el MeA masculino recibe entradas de casi un orden de magnitud más de neuronas AOB que las que se ven en el MeA femenino. No encontramos evidencia de diferencias sexuales en las propiedades electrofísicas intrínsecas de este subconjunto de neuronas MeA, lo que sugiere que la diferencia en el volumen de sinapsis que conectan el AOB con el MeA podría ayudar a crear las diferencias sexuales en los comportamientos sociales de los ratones mediados por esta región.
Visite eNeuro para leer el artículo original y explorar otros contenidos. Lea otros resúmenes de los artículos eNeuro y JNeurosci en la colección Neuronline SfN Journals: Research Article Summaries .
Muscarinic-Dependent miR-182 and QR2 Expression Regulation in the Anterior Insula Enables Novel Taste Learning. Nathaniel L. Gould, Alina Elkobi, Efrat Edry, Jonathan Daume, and Kobi Rosenblum. eNeuro 26 March 2020, 0067-20.2020; DOI: 10.1523/ENEURO.0067-20.2020

Comentarios